93/42/EEC(MDD)
國際法規
醫療器材製造商,CE標誌有助於證明您的器材符合性。醫療器材(MDD)93/42/EEC指令為進入歐盟市場的合格證明,選擇一個專業的合作夥伴所頒發的EC自我符合性聲明證書,將保證快速、高效地獲得進入國際市場的許可。
服務
我們的專家從前端設計、生產到上市,我們在各個階段,為醫療器材供應商和製造商, 提供引導產品通過樣品測試和評估及建議,滿足標準和法規的要求,替客戶提供一站式測試解決、組合服務的方案。
獲益
我們所代理頒發的證書廣受國際認可,是歐盟指令的認證機構之一。通過CE認證的新產品和後續產品,將是獲得歐盟市場初步評估的門票之一,進入歐盟成員國的保障。(歐盟指令對所有進入歐盟市場的產品作出了強制性要求。)
相關資訊
流程圖:
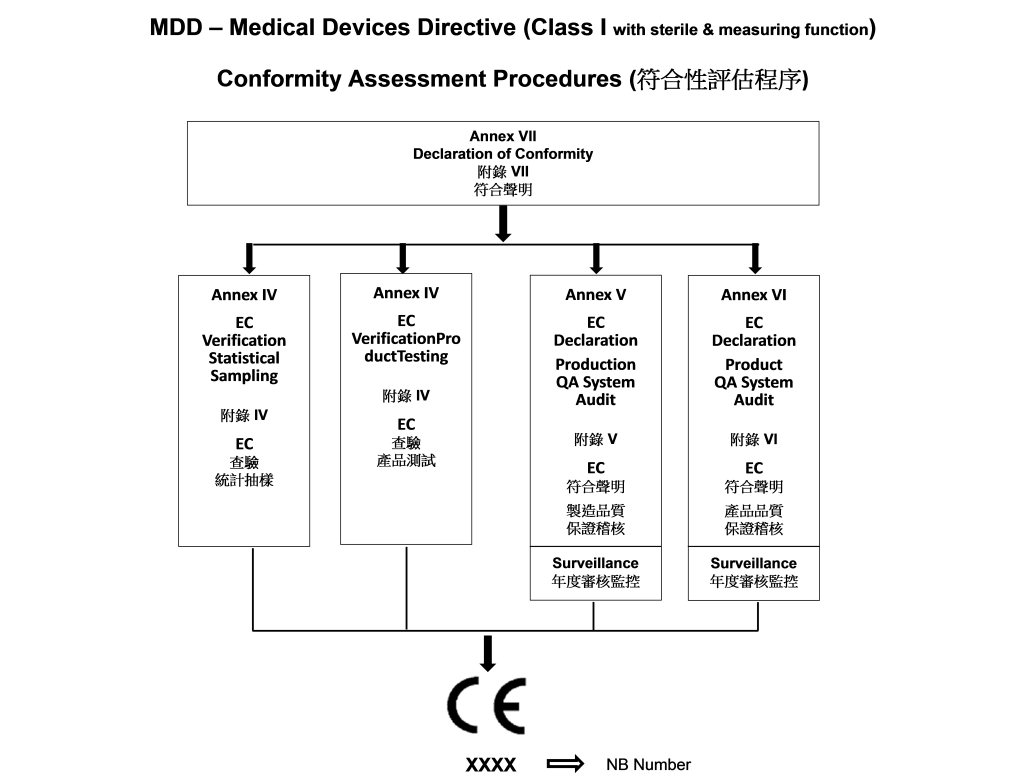
- 符合性評估程序 Class I
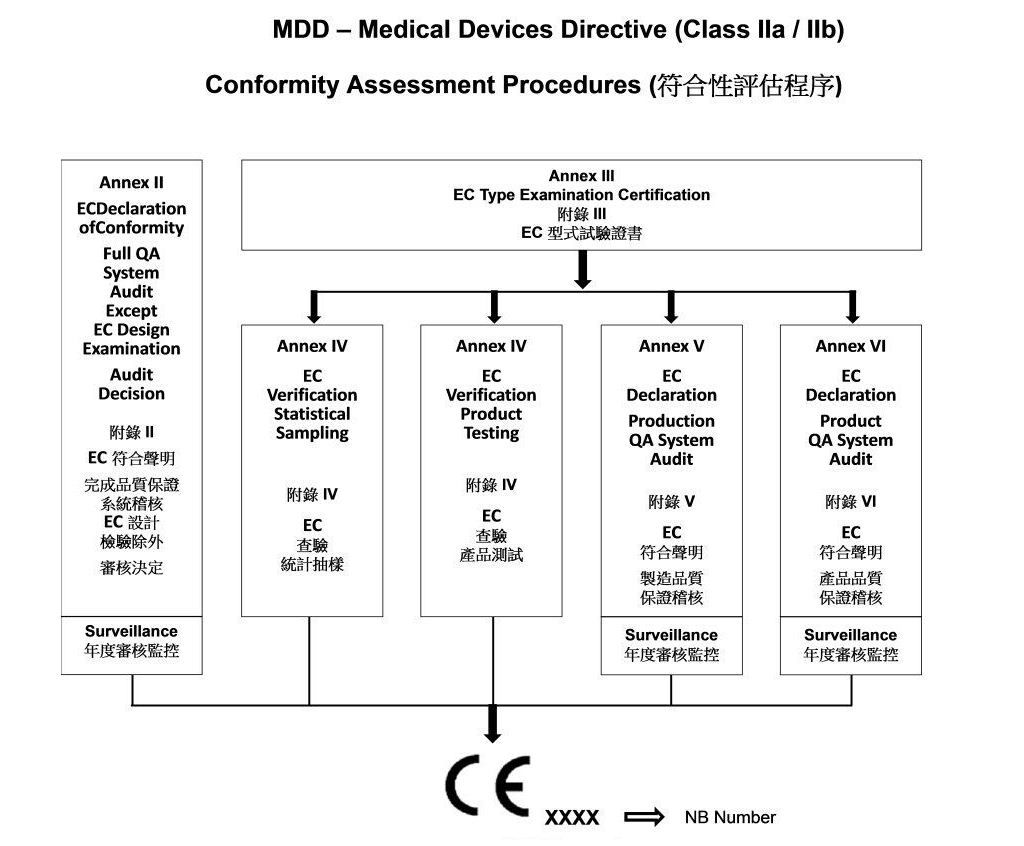
- 符合性評估程序 Class IIa/IIb
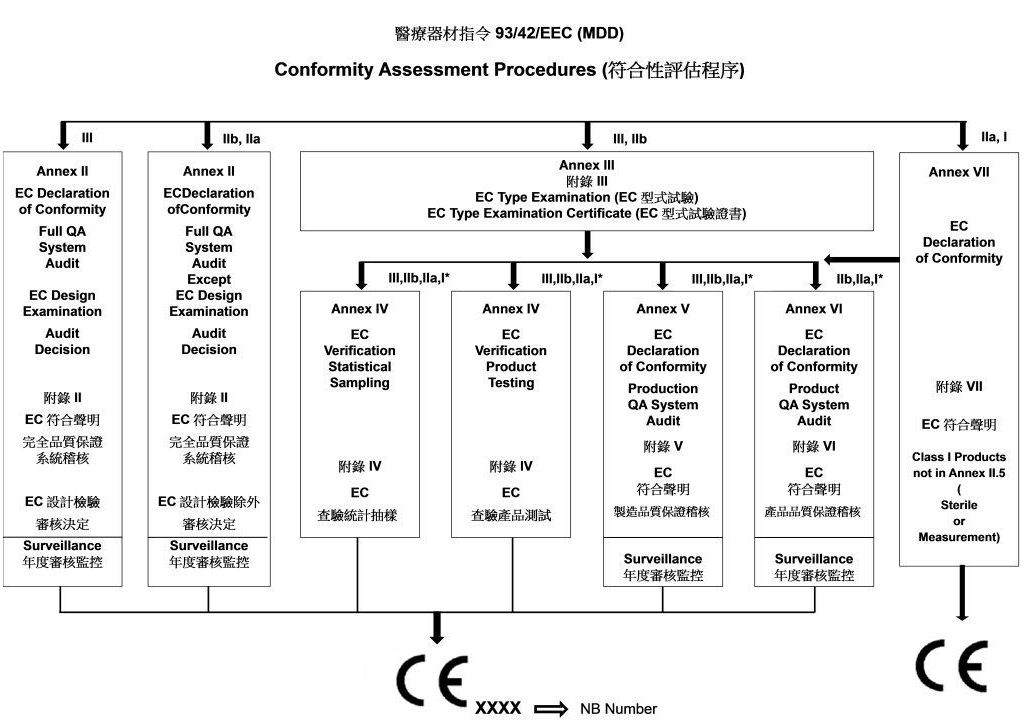
- 符合性評估程序醫療器材指令 93/42/EEC (MDD)
回到頁首







 www.udemltd.com.tr
www.udemltd.com.tr www.fda.gov.tw
www.fda.gov.tw www.taftw.org.tw
www.taftw.org.tw www.bsmi.gov.tw
www.bsmi.gov.tw www.healthnews.com.tw
www.healthnews.com.tw